Malgré la parution de ces quelques articles d’actualisation des connaissances départementales des libellules et la réalisation d’une liste d’espèces de libellules déterminantes en Poitou-Charentes, il manquait un véritable travail d’inventaire, homogène et synthétique sur le territoire régional. Un tel outil s’avérait indispensable pour définir et mettre en œuvre des mesures de conservation efficaces en faveur des espèces les plus menacées.
Ainsi après une première année de mise en œuvre dans les Charentes en 2001, un programme d’inventaire des libellules, piloté par Poitou-Charentes Nature, s’est étendu à la région. Il a permis une structuration de la collecte d’informations et a démultiplié les énergies.
Organisation de l’inventaire
Structuration du réseau de collecte des données
Afin de couvrir l’ensemble du territoire du Poitou-Charentes, un partage de compétences a été instauré au niveau régional dès 2002.
La coordination technique régionale a été assurée par l’association Charente Nature. Un coordinateur départemental a également été désigné au sein de chaque association partie prenante : Charente Nature pour le département de la Charente, la Ligue pour la Protection des Oiseaux (LPO) pour la Charente-Maritime, Deux-Sèvres Nature Environnement pour les Deux-Sèvres et Vienne Nature pour la Vienne.
Ces coordinateurs départementaux avaient pour rôle d’animer et de former un réseau local de bénévoles naturalistes, d’orienter les prospections de terrain en fonction des bilans annuels réalisés, de centraliser les fiches d’inventaires, de saisir les données dans une base informatique, tout en exerçant une vérification des informations et une validation scientifique. Ces personnes sont de loin, les mieux placées pour valider ou non les informations collectées, ayant une bonne expérience en matière d’odonatologie et connaissant de façon approfondie le territoire de leur département, les différents habitats qui le composent et la grande majorité des localités prospectées.
Formation des bénévoles et sensibilisation du public
 Au cours de l’inventaire, plusieurs journées de formations départementales et régionales ouvertes à un large public, ont été réalisées annuellement en Poitou-Charentes. Ces journées de travail, qui se sont déroulées sur le terrain ou en salle en fonction des thématiques abordées, ont permis d’initier les participants aux techniques de prospection et d’identification des imagos, mais également à celles des exuvies (clés de détermination, loupes binoculaires…). Ainsi, près d’une centaine de naturalistes a été formée sur ces aspects et a pu par la suite, participer activement à la récolte des données de terrain.
Au cours de l’inventaire, plusieurs journées de formations départementales et régionales ouvertes à un large public, ont été réalisées annuellement en Poitou-Charentes. Ces journées de travail, qui se sont déroulées sur le terrain ou en salle en fonction des thématiques abordées, ont permis d’initier les participants aux techniques de prospection et d’identification des imagos, mais également à celles des exuvies (clés de détermination, loupes binoculaires…). Ainsi, près d’une centaine de naturalistes a été formée sur ces aspects et a pu par la suite, participer activement à la récolte des données de terrain.
L’information et la sensibilisation du public sont des actions nécessaires pour faire connaître les libellules et initier une prise de conscience concernant la place de ce groupe faunistique dans notre environnement, ainsi que le rôle primordial des milieux humides pour la biodiversité.
 Une cinquantaine de sessions de sensibilisation a ainsi été réalisées entre 2002 et 2006 dans tous les départements du Poitou-Charentes. Selon les auteurs et les lieux, ces actions ont pris la forme de sorties de découverte, de projections diapos, de conférences, d’articles de presse, d’émissions de radio, de panneaux ou encore de stands, comme au Festival International du Film Ornithologique de Ménigoute en 2002.
Une cinquantaine de sessions de sensibilisation a ainsi été réalisées entre 2002 et 2006 dans tous les départements du Poitou-Charentes. Selon les auteurs et les lieux, ces actions ont pris la forme de sorties de découverte, de projections diapos, de conférences, d’articles de presse, d’émissions de radio, de panneaux ou encore de stands, comme au Festival International du Film Ornithologique de Ménigoute en 2002.
En 2002, la base d’un réseau de naturalistes s’est constitué, auquel au fil des ans, sont venues régulièrement s’ajouter de nouvelles volontés.

Mise en place d’une lettre d’info régionale : « la libelluline »
 A l’origine, uniquement prévue pour le groupe odonates de la Vienne, « La Libelluline », créée en 2004, était une publication ouverte à tous les amoureux des Libellules. Il s’agissait d’un outil permettant de communiquer et d’échanger des informations entre naturalistes.
A l’origine, uniquement prévue pour le groupe odonates de la Vienne, « La Libelluline », créée en 2004, était une publication ouverte à tous les amoureux des Libellules. Il s’agissait d’un outil permettant de communiquer et d’échanger des informations entre naturalistes.
Cette initiative permettant de nourrir une dynamique odonatologique, est devenue régionale par la suite, permettant de faire un état des résultats des prospections déjà réalisées, ainsi que des dernières découvertes. En devenant régionale, cette feuille de liaison a accompagné le programme d’inventaire tout au long de sa durée.
État des connaissances odonatologiques
 Réalisé en 2001 dans chaque département de la région par les coordinateurs, cet état des connaissances de l’odonatofaune était basé sur l’analyse des données bibliographiques et des collections privées, ainsi que des données de terrain associatives. Ces analyses croisées utilisant uniquement les informations vérifiables et contrôlées sur un lot de données relativement restreint, ont permis de dresser un premier bilan des espèces présentes en région Poitou-Charentes ainsi que leur répartition. De fortes lacunes sont donc apparues, aussi bien sur le nombre d’espèces recensées dans chaque département, que sur leur répartition spatiale.
Réalisé en 2001 dans chaque département de la région par les coordinateurs, cet état des connaissances de l’odonatofaune était basé sur l’analyse des données bibliographiques et des collections privées, ainsi que des données de terrain associatives. Ces analyses croisées utilisant uniquement les informations vérifiables et contrôlées sur un lot de données relativement restreint, ont permis de dresser un premier bilan des espèces présentes en région Poitou-Charentes ainsi que leur répartition. De fortes lacunes sont donc apparues, aussi bien sur le nombre d’espèces recensées dans chaque département, que sur leur répartition spatiale.
Ce document de base à donc été utilisé en début de programme pour orienter les prospections et motiver les naturalistes du réseau, afin d’enrichir grandement les lots de données et d’améliorer sensiblement la connaissance du statut, de la répartition et de l’écologie de chaque espèce présente dans notre région.
Développement des outils de l’inventaire Code de déontologie
Code de déontologie
Dans le cadre de cet inventaire, les naturalistes des associations concernées devaient faire preuve du plus grand respect des libellules comme de leurs milieux de vie. Pour cette raison, un code de déontologie de l’odonatologue a été établi en début de programme.
Essentiellement basé sur le code de déontologie réalisé antérieurement par la Société Française d’Odonatologie (SFO) en 1992 et modifié en 2005, il a permis notamment à tout participant de définir les conditions d’observation et de récolte des données, tout en se conformant aux réglementations locales en vigueur, ainsi qu’à la notion de « propriété privée ».
Protocoles d’inventaire
En début de programme, les prospections ont été réalisées sur l’ensemble des départements en fonction de la répartition géographique des prospecteurs. L’état initial des connaissances et les bilans annuels qui seront réalisés par la suite, permettront d’orienter les prospections (secteurs géographiques peu ou pas inventoriés.).
Pour faciliter les prospections, un maillage cartographique a été retenu régionalement. Il a été défini au dixième de grade, chaque maille représentant un quart de carte IGN au 1/25000ème, soit un rectangle approximatif de 7×10 km. Ce découpage correspond également aux autres valorisations cartographiques des atlas régionaux déjà existants : chiroptères, reptiles et amphibiens.
Fiche de terrain
Une fiche de collecte de données a été créée lors de la mise en place de l’inventaire. Un formulaire devait être rempli pour chaque sortie sur chaque site inventorié. Il est constitué de plusieurs parties fournissant les informations nécessaires pour la prise en compte des observations réalisées. La première partie apporte les renseignements nécessaires sur la date et sur la localisation des observations : carte IGN, altitude, coordonnées géographiques ainsi que le type d’habitat principal du site prospecté. La deuxième partie renseigne les espèces observées et leur comportement. L’ensemble des espèces présentes ou potentiellement présentes en Poitou-Charentes est déjà listé, et l’observateur n’avait plus qu’à remplir les cases concernant les effectifs (selon la codification définie), le stade de développement et le comportement de l’espèce.
Aide à l’identification
Dans le cadre de cet inventaire, plusieurs outils d’aide à l’identification des libellules ont été réalisés pour faciliter la tâche des observateurs de terrain. Ces initiatives, le plus souvent départementales, ont pris diverses formes : un livret de terrain, ne prenant en compte que les espèces potentiellement présentes en Poitou-Charentes a été réalisé en Charente, ainsi qu’une clé simplifiée d’aide à la détermination des exuvies. En Charente-Maritime, un document spécifique sur l’identification des odonates, présentant leur morphologie ainsi que de nombreux conseils pour l’observation et l’identification, a également été réalisé.
Centralisation, saisie des données, bases de données informatiques et système SIG
Les fiches de relevé recueillies auprès des observateurs de terrain ont été centralisées par chaque coordinateur départemental. Toutes les informations ont été classées, triées, puis validées par ce dernier. Toutes les informations suspectes ont été vérifiées ou écartées. Une fois la validation effectuée, les données ont été saisies dans des bases informatiques départementales, puis regroupées par la suite dans une base régionale. Désormais, un fond documentaire extraordinaire est constitué permettant la réalisation de cartographies, de lister les espèces les plus menacées, de déterminer quels sont les sites essentiels à préserver et de définir une stratégie d’action. Cette banque de données constitue par ailleurs un état initial qui permettra la mise en place de suivis et constituera un état des connaissances indispensable aux générations futures pour évaluer dans le temps l’impact des modifications affectant les écosystèmes aquatiques du Poitou-Charentes.
Collecte des données
Les méthodes classiques d’identification ont été mises en œuvre à la fois sur l’identification des imagos ou sur celle des exuvies. Cette dernière source d’information a été privilégiée pour les anisoptères, car elle apporte des informations pertinentes sur le statut de reproduction des espèces. Pour les captures au filet, des autorisations préfectorales temporaires de capture concernant les espèces de libellules protégées ont été obtenues par les coordinateurs départementaux et quelques autres prospecteurs.
La recherche des larves
La collecte des larves s’effectue à l’aide d’un filet troubleau ou d’un tamis, en raclant le substrat ou la végétation immergée d’un point d’eau. La détermination des larves repose sur les critères proposés dans les publications thématiques de plusieurs auteurs : Gerken et Sternberg (1999), Heidemann et Seidenbush (2002).
Cette technique de recherche a été peu utilisée au cours de cet inventaire, et n’a concerné que des espèces de détermination et de récolte aisées (anax, cordulégastre, onychogomphes par ex.). Ainsi, 52 larves ont été récoltées et identifiées ces dernières années.
C’est quoi une donnée ?
Une donnée se définit par l’observation d’au moins un individu d’une espèce donnée en un lieu précis, à une date donnée, par un ou plusieurs observateurs. Ces éléments peuvent être amendés d’informations complémentaires telles que : le nombre, le sexe, le comportement et le milieu.
La recherche des exuvies
De nombreuses récoltes d’exuvies ont été effectuées le long des berges des plans d’eau et des rivières, grandement facilitées par l’utilisation du canoë. Ces dépouilles larvaires constituent des preuves formelles de présence et de reproduction, et permettent une identification précise des espèces. Cette source d’information a essentiellement été privilégiée pour les anisoptères, plus faciles à identifier. Dans la mesure du possible, des recherches d’exuvies ont été faites sur chaque localité inventoriée. Des prospections ciblées sur certains milieux (étangs, fleuve…) ou sur certaines espèces (Cordulie splendide Macromia splendens, Epithèque bimaculée Epitheca bimaculata, Gomphe à pattes jaunes Gomphus flavipes…) ont également été organisées.
Par la suite, ces exuvies ont été identifiées en salle avec une loupe à main pour les espèces à détermination aisée et avec une loupe binoculaire pour celles qui demandent une étude plus détaillée. Des collections de référence ont dès lors pu ainsi être réalisées dans chaque département. Ainsi, 70026 exuvies ont pu être identifiées au niveau spécifique dans le cadre de cet inventaire, représentant 5545 données de reproduction certaine.
La recherche des imagos
 Il s’agit de repérer les insectes adultes, en émergence, en chasse ou en phase de maturation. L’identification des imagos se fait essentiellement en main, après capture, généralement à l’aide d’un filet à papillons. Les insectes sont identifiés après observation de tous les critères diagnostiques et relâchés sur place. Cette démarche ne prend en général que quelques secondes à quelques minutes. Certaines espèces sont peu discrètes et aisément identifiables à distance. Dans ce cas, des jumelles à mise au point rapprochée peuvent être utilisées pour l’identification.
Il s’agit de repérer les insectes adultes, en émergence, en chasse ou en phase de maturation. L’identification des imagos se fait essentiellement en main, après capture, généralement à l’aide d’un filet à papillons. Les insectes sont identifiés après observation de tous les critères diagnostiques et relâchés sur place. Cette démarche ne prend en général que quelques secondes à quelques minutes. Certaines espèces sont peu discrètes et aisément identifiables à distance. Dans ce cas, des jumelles à mise au point rapprochée peuvent être utilisées pour l’identification.
D’autres techniques de recherche on également été utilisées. Il s’agit par exemple d’examens des toiles d’araignées, ou l’utilisation de petits bolas, selon une technique asiatique dite « buri » ou « toriko » (Hatto, 1994). Cette technique consiste au passage d’une grande libellule, de jeter de petites boules d’entrave faites de gravillons, reliées par un fil de soie. Elle permet de faire descendre des espèces qui chassent au niveau de la canopée des arbres. 
Enfin, quelques informations proviennent de découverte de cadavres et de recherches des indices de ponte, notamment pour le Leste vert Chalcolestes viridis. Cette méthode est basée sur la recherche des cicatrices de ponte caractéristiques sur les ramilles de certains arbres.
Pression d’observation et couverture de prospection
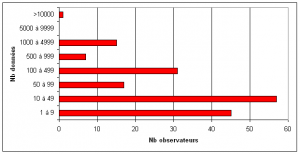
L’essentiel des données régionales ont été collectées entre 2002 et 2006, correspondant à la période de l’inventaire régional. Au cours de cet inventaire, 212 naturalistes compétents et passionnés, dont 206 bénévoles, ont participé activement à la transmission des données ce qui représente des milliers d’heures de terrain. Parmi ces observateurs, la majorité d’entre eux ont fourni de 1 à 100 données, et près d’une cinquantaine ont participé à la transmission de plusieurs centaines de données (figure 12).
Ainsi, près de 61 000 données originales ont pu être collectées au cours de cette période, dont plus de 30 000 au cours des seules années 2004 et 2005. Seules les données plus remarquables ont été intégrées par la suite.
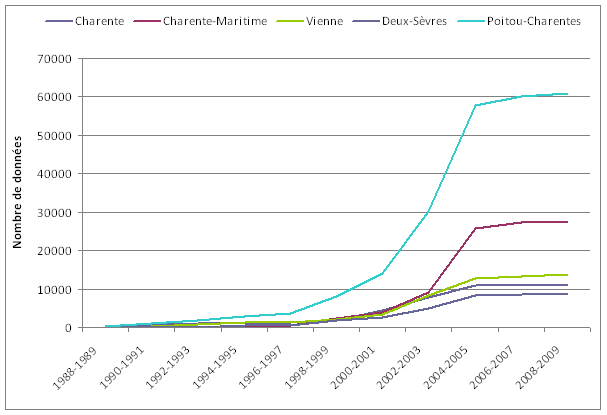
Couverture des prospections
Des efforts particuliers ont été réalisés pour prospecter de façon la plus exhaustive possible l’ensemble du territoire régional. Des analyses régulières ont permis de réorienter les recherches afin que tous les types de milieux aquatiques (lotiques, lentiques, marais.) soient prospectés. Des prospections ciblées sur des secteurs géographiques peu ou pas inventoriés, ont également été organisées, ainsi que des recherches spécifiques concernant des espèces peu communes ou inféodées à des milieux précis.
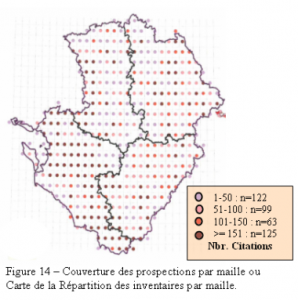
Ainsi, la couverture géographique s’est largement homogénéisée sur l’ensemble du territoire régional les dernières années d’inventaire, et la pression d’observation a nettement augmenté. Désormais, la quasi-totalité des mailles du Poitou-Charentes a été prospectée (figure 14).
Pour la valorisation cartographique des données, le maillage a été le même que celui utilisé pour les prospections, soit le 10e de Grades Paris. Cependant, certaines informations pertinentes ont également été valorisées à une échelle plus précise, c’est-à-dire à la commune ou à la station.
Ainsi, la pression d’observation peut être évaluée en cartographiant la répartition des données à ces trois niveaux. Ces trois modes de représentation sont complémentaires et permettent de formuler d’intéressants commentaires.
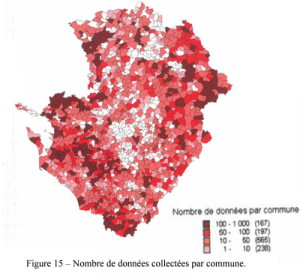
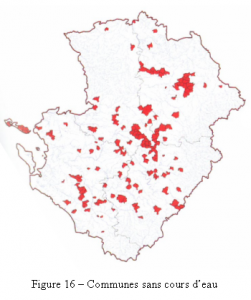
Les cartes qui en découlent permettent de visualiser les efforts de prospection et les différences interdépartementales. Ces différences sont de diverses origines, et peuvent correspondre à des manques de prospections, mais il s’agit bien plus souvent d’absence de réseaux hydrographiques ou de points d’eau dans les secteurs concernés (figures 15 et 16).
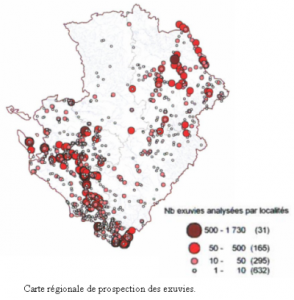
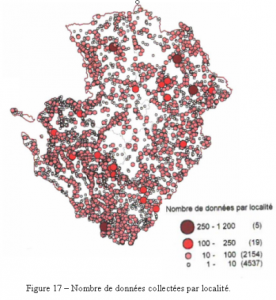
La carte des données par localité (figure 17) permet de visualiser les grands réseaux hydrographiques, ce qui traduit une bonne couverture de l’inventaire.
La carte du nombre de données par maille démontre l’homogénéité de la couverture au plan régional, mais illustre aussi une certaine hétérogénéité dans l’effort de prospection.
Sur les 1 475 communes de la région, 1 119 d’entre elles (76 %) possèdent sur leur territoire au moins un site sur lequel au minimum une observation de libellule a été réalisée durant la période d’inventaire (figure 15). Parmi les 356 autres, on trouve en majorité des communes sur le territoire desquelles aucun milieu humide n’existe (figure 16). Les zones plus claires sur les cartes (figures 15 et 17) montrent en fait les espaces totalement ou partiellement vides de zones humides favorables au développement des libellules. C’est en particulier le cas pour la majorité des grandes plaines céréalières de la région.
Huit communes rassemblent plus de 500 données, 2 en Vienne, 5 en Charente-Maritime et 1 en Deux-Sèvres. Parmi celles-ci deux d’entre-elles recueillent plus de 1 000 données, il s’agit de Vouneuil-sur-Vienne (1 267 données) et de Lussac-les-Châteaux (1 193 données) dans le département de la Vienne.
Au total, 5 839 localités (ou sites) ont été prospectées. Deux localités recueillent à elles seules 2 200 données, il s’agit des landes du Pinail à Vouneuil-sur-Vienne et des Grandes Brandes à Lussac-Les-Châteaux, en Vienne. La présence de la Réserve Naturelle du Pinail pour la première en est la principale raison. En effet, cette étendue de 135 hectares de landes à Bruyère à balais, criblée par plus de cinq mille mares issues d’anciennes fosses d’extraction de pierres meulières, en fait un site d’intérêt régional pour les libellules. Cet espace protégé est géré, depuis 1989 par l’Association de GEstion de la REserve Naturelle du PInail (GEREPI) qui en assure le suivi scientifique, ce qui explique le nombre important de données de libellules.
On peut comparer le site des Grandes Brandes à un mini Pinail, puisqu’il s’agit la aussi d’une zone de landes de 32 ha parsemés de plus de 550 mares résultant de l’extraction de pierres meulières et de la marne. Géré par le Conservatoire des Espaces Naturels depuis 1989 et intégré dans le site Natura 2000 « Forêt et pelouses de Lussac », ce site fait l’objet depuis 2004 d’un suivi odonatologique par Vienne Nature, ce qui explique également le nombre important de données récoltées.
Hormis ces sites riches et très suivis, 24 autres localités du Poitou-Charentes totalisent plus de 100 données.
Laurent PRECIGOUT, Philippe JOURDE, Eric PRUD’HOMME
 En Poitou-Charentes, cette pression s’est particulièrement exercée sur les zones humides connexes aux rivières et ruisseaux, dans les lits majeurs. Ces espaces, qui servent de zones naturelles d’expansion des crues et qui sont des réservoirs importants de biodiversité ont en effet, pour beaucoup, été profondément transformés au profit de la culture du maïs ou de la populiculture. Le changement radical de gestion hydraulique des cours d’eau opéré à partir des années 1960, à base de grands travaux de curage et de mise en place de barrages, a également conduit à l’assèchement des zones humides et à leur dégradation à vaste échelle. L’augmentation et la généralisation des traitements phytosanitaires utilisés en agriculture et par les jardiniers amateurs, s’ajoutent aux polluants d’origine industrielle et contribuent à une dégradation très importante des milieux aquatiques.
En Poitou-Charentes, cette pression s’est particulièrement exercée sur les zones humides connexes aux rivières et ruisseaux, dans les lits majeurs. Ces espaces, qui servent de zones naturelles d’expansion des crues et qui sont des réservoirs importants de biodiversité ont en effet, pour beaucoup, été profondément transformés au profit de la culture du maïs ou de la populiculture. Le changement radical de gestion hydraulique des cours d’eau opéré à partir des années 1960, à base de grands travaux de curage et de mise en place de barrages, a également conduit à l’assèchement des zones humides et à leur dégradation à vaste échelle. L’augmentation et la généralisation des traitements phytosanitaires utilisés en agriculture et par les jardiniers amateurs, s’ajoutent aux polluants d’origine industrielle et contribuent à une dégradation très importante des milieux aquatiques. Les diverses pollutions, par les pesticides, les fertilisants, les cyanophycées, ou encore le phosphore, entraînent, quant à elles, une dystrophie des milieux qui affectent les cours d’eau. Ceci se révèle très défavorable aux libellules, dont les cortèges se retrouvent appauvris. Seules quelques espèces ubiquistes et très tolérantes comme l’Agrion élégant Ischnura elegans ou la Naïade au corps vert Erythromma viridulum arrivent, dans certains cas, à s’adapter.
Les diverses pollutions, par les pesticides, les fertilisants, les cyanophycées, ou encore le phosphore, entraînent, quant à elles, une dystrophie des milieux qui affectent les cours d’eau. Ceci se révèle très défavorable aux libellules, dont les cortèges se retrouvent appauvris. Seules quelques espèces ubiquistes et très tolérantes comme l’Agrion élégant Ischnura elegans ou la Naïade au corps vert Erythromma viridulum arrivent, dans certains cas, à s’adapter.






 A l’origine, uniquement prévue pour le groupe odonates de la Vienne, « La Libelluline », créée en 2004, était une publication ouverte à tous les amoureux des Libellules. Il s’agissait d’un outil permettant de communiquer et d’échanger des informations entre naturalistes.
A l’origine, uniquement prévue pour le groupe odonates de la Vienne, « La Libelluline », créée en 2004, était une publication ouverte à tous les amoureux des Libellules. Il s’agissait d’un outil permettant de communiquer et d’échanger des informations entre naturalistes. Réalisé en 2001 dans chaque département de la région par les coordinateurs, cet état des connaissances de l’odonatofaune était basé sur l’analyse des données bibliographiques et des collections privées, ainsi que des données de terrain associatives. Ces analyses croisées utilisant uniquement les informations vérifiables et contrôlées sur un lot de données relativement restreint, ont permis de dresser un premier bilan des espèces présentes en région Poitou-Charentes ainsi que leur répartition. De fortes lacunes sont donc apparues, aussi bien sur le nombre d’espèces recensées dans chaque département, que sur leur répartition spatiale.
Réalisé en 2001 dans chaque département de la région par les coordinateurs, cet état des connaissances de l’odonatofaune était basé sur l’analyse des données bibliographiques et des collections privées, ainsi que des données de terrain associatives. Ces analyses croisées utilisant uniquement les informations vérifiables et contrôlées sur un lot de données relativement restreint, ont permis de dresser un premier bilan des espèces présentes en région Poitou-Charentes ainsi que leur répartition. De fortes lacunes sont donc apparues, aussi bien sur le nombre d’espèces recensées dans chaque département, que sur leur répartition spatiale.